首页 -> 2008年第5期
碳与浓硝酸反应的实验创新设计
作者:贾绍明
(一)有关难题及其妙解
难题1:主反应的有效证明。
在碳与浓硝酸反应的同时,往往伴随着浓硝酸的分解,即
C+4HNO3=4NO2 +CO2 +2H2O
红棕色 无色
4HNO3=4NO2 +O2 +2H2O
红棕色 无色
因为两个反应都产生NO2,所以主反应的发生就不能简单通过观察红棕色气体的产生来判断,而应该通过检验CO2加以确认。如果用澄清石灰水,一方面CO2在整个气体混合物中所占比例小于20%,另一方面NO2的溶解会优先消耗掉碱,那么检验CO2必须在主反应装置以外的地方进行,且使用较浓的氢氧化钡溶液比用澄清石灰水更好,其反应方程式为
CO2+Ba(OH)2=BaCO3 +H2O
实验结果证明了笔者的预测是正确的。
难题2:主反应条件的准确把握。
碳与浓硝酸反应需要加热,但加热的方法有四种选择,即:①将木炭与浓硝酸一同放在装置中加热;②先加热浓硝酸,然后将木炭投入其中;③先加热木炭,再加入冷浓硝酸;④先加热木炭,再将木炭投入冷浓硝酸之中。因为浓硝酸分解的温度很低,所以①②两种方法将使装置中产生太多的NO2,同时也会使装置中的压强过大;方法③④中反应物的受热主要集中在接触面上,但方法③还需添加分液漏斗和铁架台等仪器,装置将变得复杂,综上所述,方法④是把握加热条件的最佳选择。
难题3:实验时间的轻松掌控。
因为反应中有毒性气体NO2产生,所以实验必须在密闭装置中完成,这时装置中的气体流动和 CO2与氢氧化钡溶液的反应快慢就成为影响实验所需时间的又一难题。解决的思路是用一种仪器,既能反复吸气和吹气又能将氢氧化钡溶液搅动,于是想到了洗耳球和胶头滴管(后改为胶头直角导管),再结合比较操作简便、保持装置密闭性等方面的优劣,最终选择了后者,并让其下端略低于氢氧化钡溶液的液面。
难题4:毒性尾气的安全处理。
众所周知,一个好的实验设计方案应该是绿色环保的实验方案,但是现在设计者一般只注意到不让有害气体排放到空气中,相应地往往也只在末端增加尾气吸收装置,至于装置内的残留有害气体肯定没有得到妥善处理,当把这样的装置拿回实验室洗涤时,仍然免不了被教师吸入的后果。为了彻底解决类似的问题,在本实验中,笔者根据NO2和氢氧化钡溶液的性质,用检验CO2后过量的氢氧化钡溶液吸收装置内的NO2,收到了很好的效果。反应为:4NO2+O2+2Ba(OH)2=2Ba(NO3)2+2H2O。
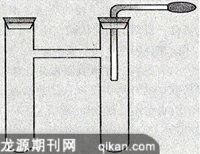
难题5:整套实验装置的简化。
本实验所需装置必须满足以下要求:①有碳与浓硝酸的反应装置;②有CO2的检验装置并与装置①相连;③胶头直角导管与装置②相连;④整个装置处于密闭状态。经多方比较,确定的装置如左图所示:
(二)实验步骤及主要现象
1.在H型试管的右管中加入适量氢氧化钡溶液,液面略高于胶头导管的下端,塞紧橡皮塞;
2.取1ML左右浓硝酸于H型试管的左管,将一小块花生米大小的硬实木炭放在火焰上灼烧至红热,投入到浓硝酸中,立即塞紧橡皮塞,观察左管内很快充满红棕色气体;
3.在胶头导管内的液面上升至拐角前开始挤压乳胶头,反复将吸入的液体压回,增大装置内气体的流动性,使气液接触更加充分,观察右管内白色沉淀的产生;
4.逆时针旋转装置90度,让未反应完的氢氧化钡溶液流入H型试管的左管,用以中和残留的硝酸并吸收NO2,防止毒气逸出。