首页 -> 2007年第12期
中职化学课堂教学中学生生成性资源的开发
作者:王升初
关键词:中职;化学;课堂教学;生成性资源
学生、教师、教材都是教学的资源。课堂教学中的生成性资源是指在教学过程中形成的对教学起支持作用的或具有潜在教育价值的事件。学生的生成性资源是指来源于学生、通过师生互动及生生互动生成的资源,包括学生超出教师课前教学预设的问题或回答、课堂中突发的事件或学生的特殊表现等。中职学生大都学习基础较差,学习情绪不高。因此,在中职化学课堂教学中,应注重对学生生成性资源的开发,借以激发学生学习的主动性,改善学习状况。
学生生成性资源
在中职化学课堂教学中,教师不仅要对学生生成性资源有正确的认识,还要结合中职学生的实际情况对其进行合理开发,把握利用学生生成性资源的主动权。笔者在实际教学中常用以下方法开发学生生成性资源。
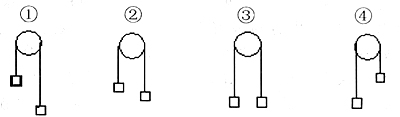
创设情境激活学生生成性资源教师在课堂上创设某种情境,使学生产生积极的参与情绪。学生处于高度兴奋状态或心情放松时,思维敏捷,常会出现奇思妙想。此时的奇思妙想可成为活跃课堂气氛、引发教师授课灵感的生成性资源。由于情境诱发,师生情感距离得以拉近,学生的潜能得到充分发挥。这时,学生经常会在处理问题的某一方面或某一环节显出优势,教师可将这些“小成就”作为教育、鼓励学生的“个体资源”。例如,在学习氧化还原反应时,要分析:(1)CaH2+2H2O=Ca(OH)2+2H2↑(2)KClO3+6HCl=KCl+3Cl2↑+3H2O等反应的电子转移情况时,涉及“价态归中规律”。教材中没有明确分析这个问题,然而,试卷中该知识点的出现频率却很高。针对这一情况,本人在教学中,从比较氧化性和还原性强弱入手,将其比作“人的力气大小”,由学生自主讨论。学生联想到质量大小、重力大小、拔河比赛等,部分学生联系到物理学中的“定滑轮”装置。笔者抓住了学生这些思想上的闪光点,引导他们完善了采用“定滑轮”判断同种元素不同价态之间氧化还原反应的方法(见下图)。图中,从①到④是高价态逐渐降低、低价态逐渐升高的过程,③到④的过程不成立,因为同种元素不同价态之间的氧化还原反应“只靠拢不交叉”,相邻价态之间不发生氧化还原反应。这样,通过创设情境挖掘学生的生成性资源,摒弃了抽象的讲述方式,用生动的模型演示变化过程,帮助学生理解抽象的理论知识,起到了事半功倍的效果。
放大利用与缩小利用相结合当学生生成性资源与课堂教学重点相吻合时,将学生的资源加以引伸,提出质疑,让学生自己给出问题的答案,将学生的小问题加以放大利用。例如,制备Fe(OH)2的实验会出现白色乳状沉淀,笔者在教学中要求学生根据Fe(OH)2在空气中极易被氧化的性质,分组讨论设计实验,并根据学生的设计,演示该实验:(1)在试管中加入少量非新制的FeSO4溶液,并在液面上滴加NaOH溶液;(2)在试管中加入少量非新制的FeSO4溶液,然后,用滴管吸取少量NaOH溶液插入FeSO4溶液底部,缓缓挤出NaOH溶液;(3)在试管中加入未经处理的用蒸馏水新配制成的少量FeSO4溶液,然后,在液面处滴加NaOH溶液;(4)在试管中滴加未经处理的用蒸馏水新配制成的少量FeSO4溶液,然后,用滴管吸取少量NaOH溶液插入FeSO4溶液底部,缓缓挤出NaOH溶液。结果上述实验均没有出现白色乳状沉淀。此时,引导学生探究实验失败的原因,学生的积极性被极大调动,跃跃欲试,经过讨论总结出以下要点:(1)应使用新配制的FeSO4溶液,配制溶液时应使用煮沸过的蒸馏水(尽可能减少水中的O2);(2)参与反应的NaOH溶液应该加热煮沸;(3)应将吸有NaOH溶液的滴管伸入FeSO4溶液底部,缓缓挤出NaOH溶液(避免氧气在挤出过程中带入)。然后,根据上述要点重新进行实验,终于观察到了白色沉淀。与之相对应的是缩小原则,即当学生生成资源价值不大时,将其适当缩小,一带而过,不花费过多时间处理。例如,在做乙醛与氢氧化铜反应实验时,有学生提出“为什么氢氧化钠溶液要过量”的问题。考虑到学生的接受能力有限,笔者没有解释反映机理,只简单提出了学生基本能够理解的如下问题:(1)乙醛被氧化成什么?(2)生成的Cu2O能溶于乙酸吗?(3)多余的NaOH在反应中起什么作用?
即时利用与延时利用相结合如果学生的生成性资源有利于教学,教师就应及时加以捕捉、利用。例如,对于大多数初学者来说,“气体摩尔体积”的内容较为抽象,但少数学生能够联想到医用针筒,认为可以利用针筒加以说明。笔者及时借鉴这一资源,将两支相同的针筒分别吸入40ml的水和空气,然后,用橡胶塞将针筒堵住,推动活塞。结果,吸入空气的针筒的活塞可以推动,吸入水的针筒却“无动于衷”。这说明气体分子之间的距离较大,气体体积主要取决于分子间的平均距离,即取决于外部的压强和温度,而液体主要取决于微粒的大小。要确定1ml气体的体积就要采用定温度和定压强,使其过渡到标准状态下的摩尔体积。两个简单的针筒,使枯燥无味的理论知识得以活化,学生容易理解。教学中,可将不易把握、不能及时有效处理的学生生成性资源交给学生进行初步处理,让学生通过课后探究得出结果,能够收到不错的效果。例如学习苯的结构时,学生对苯环状结构存在异议。针对这一情况,在教学时,笔者布置学生组拼符合C6H6 结构的可能存在的所有球棍模型结构,并让其结合苯的性质进行比较。第二天在课堂上,多名学生自告奋勇解释自己的探究过程:(1)褪色反应:说明具有不饱和结构;(2)取代反应:一氯取代物只有一种;(3)加成反应:具有烯烃结构。这一举措,使学生听课兴趣盎然,茅塞顿开。
搭建平台展示学生生成性资源课堂上,教师可以根据教学预设让学生分组讨论。在小组讨论时,经常会涌现出表现学生差异的个体资源,可以使这些资源在小组合作过程中得到充分利用;在小组汇报或展示时,会出现集体资源。例如,在讲授Na2O2与水反应时,在Na2O2与水反应结束后,滴入酚酞试液,溶液随即变成红色,震荡后红色迅速消失。于是,便提出了这样的问题“溶液变红说明有NaOH生成,但使溶液褪色的物质是什么呢?”然后,将学生分成8个小组,让他们对反应物和可能生成的物质进行猜测,并设计实验加以证明,最后,让每个小组推选出一名同学做总结报告,小组其他成员对其进行补充。结果,学生提出了多种猜测,并附有实验及解释。如首先提出了Na2O2能够起漂白作用,在存在过量的水的情况下,Na2O2已不存在的设想。然后,在浓NaOH溶液中加入酚酞试液,发现溶液的颜色随即褪去,但随着水的加入,红色又重新出现。接着,把氧气通到品红溶液中,品红溶液没有褪色,于是,得出了氧气没有漂白作用的结论。最后,在双氧水中加入品红溶液,结果溶液褪色。于是得出结论:H2O2能起漂白作用。那么H2O2是怎样产生的呢?结合现象及结论可马上写出化学方程式:Na2O2+2H2O=2NaOH+H2O2,2H2O2=2H2O+O2↑。这样,不仅让学生的个体资源和集体资源得到充分展示,而且可以锻炼学生的胆量并激发其思维活力,从而激发出他们对化学学习的浓厚兴趣。
体会与启示
长期以来,由于课程设计上的封闭性,教师没有充分享有课程资源的决策权力,也缺少相应的应对能力。教师和学生的生活、经验、问题、困惑、理解、智慧、意愿、情感、态度、价值观等十分丰富的课程资源被排斥在教学过程之外,原本十分丰富的教学过程被简化为单一的传授书本知识和技能的过程。教师、学生在课程教学中的积极性、主动性和创造性被束缚住了,尤其是教学互动中动态的生成资源被忽视甚至被压抑了。令人欣慰的是,许多教师在教学实践活动中已经开始关注学生的生成性资源。另外,在充分利用动态生成资源的基础上,教师也应该进行深刻的反思和研究,力争做到:
[2]